국내외 줄기세포 치료제/화장품 제품연구 개발동향 및 해외시장진출
출처 : Bioin스페셜 WebZine 2012년 26호 [줄기세포 연구동향]
정형민 차바이오앤디오스텍(주) 사장
1. 서론
1) 줄기세포 치료제
줄기세포 (stem cell)는 증식능과 분화능을 지니며 신체의 항상성을 조절하는 기능을 담당하는 세포를 의미한다. 줄기세포는 세포의기원에 따라 배아(embryonic), 성체 (adult) 및 역분화 (induced pluripotent) 줄기세포로 구분하며 현재 전세계적으로 3,000여건의 세포치료제에 대한 임상시험이 진행중이며 이중 10~15%정도는 상용화를 대비한 상업임상시험 중이다. 세포치료제제 개발의 입장에서는 줄기세포의 기원에 따라 개발하는 것보다는 생체내 세포이식시 문제가 될 수 있는 면역거부반응의 정도에 따라 자가(autologous)와 동종 (allogeneic) 줄기세포로 구분하는 것이 타당하다. 세포치료제는 전세계적으로 바이오의약품으로 분류하는 것이 통상적이며 따라서 치료제로 개발하기 위해 신약개발과 동일한 기초원천기술단계, 치료제로서의 전임상시험 단계 및 임상시험단계를 거쳐 최종적으로 상용화가 가능하다. 최근 국내의 경우 세포치료제 상용화가 세계최초로 실현되는 등 줄기세포를 이용한 치료제 개발의 국제적 성과를 도출하고 있으며 우수한 임상시험기관 및 연구자 보유, 세포치료제 전문기업 보유, 치료제 개발을 위한 인허가 및 법적절차의 구비 및 전폭적인 국가지원시스템 등 세포치료제 개발을 위한 좋은 인프라가 구축되어 있어 향후 이 분야의 발전가능성은 매우 높다고 할 수 있다.
2) 줄기세포 화장품
줄기세포를 활용한 화자품 개발은 전세계적으로 전체 화장품 시장에 비교할 때 매우 적은 비율이나 최근 다국적 대형 화장품 회사나 국내의 유수 화장품 회사를 중심으로 활발히 개발되고 있는 분야이다. 줄기세포 화장품의 개발은 지난 십여년 동안의 연구를 통해 줄기세포 배양과정에서 추출되는 배양물 (conditioned media)내에 피부의 노화예방, 미백 및 주름개선등에 효과가 있는 다양한 유효성분이 함유되어 있다는 사실에 근거를 두고 있다. 줄기세포 화장품의 기원은 2007년 프랑스 화장품 개발회사인 Voss Laboratories 회사가 러시아로부터 기술이전을 통해 개발한 “Amatokin”이라는 화장품이다. 이 제품은 지방줄기세포 유래의 추출물을 활용한 제품으로서 화상등과 같은 피부창상 수복을 위해 개발하던 중 피부의 주름개선 효과가 확인되면서 노화방지용 화장품으로 개발된 것이다. 현재 줄기세포화장품에 이용되는 줄기세포는 배아, 지방, 골수, 제대혈, 태반줄기세포외에도 피부 섬유화세포나 구강점막세포 추출물에 이르기 까지 광범위하게 이용되고 있다. 이러한 인체유래의 줄기세포 혹은 체세포 추출물을 이용한 화장품 개발에 대해 각국은 안전성 등을 고려한 가이드라인 또는 규제방안을 강구하고 있는 실정이다.
2. 본론
1) 줄기세포 치료제
세포치료제 개발은 전세계적으로 초입단계에 있는 신규 바이오산업으로서 무한한 가능성을 보유하고 있으며 현재 전체 세포치료제의 50% 이상은 자가유래의 줄기세포 치료제가 주류를 차지하고 있으며 최근 다양한 성체조직 유래의 중간엽줄기세포 (mesenchymal stem cell: MSC) 치료제의 임상시험이 활발히 진행중이다.
(1) 배아줄기세포 치료제
배아줄기세포는 만능세포로서 윤리적 한계에도 불구하고 무한대의 증식능과 모든 세포로의 분화능으로 인해 세포치료제 개발시 우수한 치료적 효과를 기대할 것으로 예상되고 있다. 그러나 성체줄기세포의 경우 줄기세포의 분리 및 증식을 통해 생체내 이식하는 것과는 달리 배아줄기세포 유래의 세포치료제는 반드시 특정세포로의 분화유도, 미분화세포의 제거기술, 테라토마 등과 같은 종양발생 제거기술 및 동종세포치료제로서의 면역거부반응 해결 등의 복잡한 개발과정을 요구한다. 전세계적으로 배아줄기세포 치료제는 미국 Geron사의 급성척수손상치료제와 ACT와 차바이오앤디오스텍이 공동개발중인 스타가르트병과 건성 노인성 황반변성증에 대한 세포치료제가 유일하다. 최근 미국 Geron사의 경우 개발비용의 부담으로 인해 임상시험중단을 발표하면서 줄기세포치료제 개발의 위축을 우려하였으나 실명증 (스타가르트병과 건성 노인성 황반변성증)에 대한 세포치료제의 임상시험 진행 발표등으로 향후 이 분야의 개발의 향방을 결정할 것으로 예상된다.
저자가 소속된 차바이오앤디오스텍의 실명증 치료제는 2005년 배아줄기세포 유래의 망막색소상피세포 (retinal pigment epithelial cell: RPE)를 이용하는 것으로 망막손상으로 인한 실명증을 대상질환으로 하고 있다. 눈은 해부학적으로 면역거부반응이 나타나지 않는 기관으로서 동종줄기세포를 임상적용하기 용이하며 전임상 효력시험을 통해 매우 적을 수의 세포를 이식하여도 치료적 능력이 탁월하여 배아줄기세포 치료제 개발의 우선대상 질환으로 개발하였다.
망막손상에 의한 실명은 망막세포자체의 손상으로 세포사멸이 이루어져 drugen이라는 세포사멸물질의 축적 (건성) 또는 망막혈관 손상으로 인해 혈액침출물에 의한 망막손상 (습성)에 기인되며 이 두가지 모두 중심시력부터 손상을 초래하다 결국 실명에 이르는 질환이다. 망막색소상피세포는 전체 망막손상으로 인한 실명증의 90%를 차지하는 건성 망막손상을 대상으로 하며 청소년기에 발병하는 희귀질환인 스타가르트병과 50세 이상 실명의 제1원인인 노인성 황반변성증이 이에 해당된다. 전임상 효력시험을 통해 질환모델 동물의 망막하에 직접 세포이식을 시행한 결과 시력소실 효과가 유의하게 감소하였을 뿐만아니라 시력의 회복이 가능함을 확인하였고 최적의 세포이식수 결정시험을 통해 안구당 50,000개의 세포이식으로 질환치료가 가능함을 확인하였다. 또한 세포치료제 개발시 가장 중요한 항목 중 하나인 안전성 및 독성시험에서 in vitro assay를 통해 공정 및 품질관리된 최종 임상시험 시료내에 미분화세포가 잔존하지 않음을 확인하였고 종양원성시험을 통해 안구내 이식된 망막색소상피세포가 테라토마 등과 같은 종양발생이 일어나자 않음을 확인하였다. 또한 망막내 이식된 세포가 다른 안구를 포함하여 타 장기나 조직으로 이동하지 않음을 확인하는 분포독성을 시행함으로써 미국과 한국 식약청으로부터 임상시험 승인을 득하였다. 현재 망막색소상피세포 치료제는 미국 UCLA대학에서 스타가르트병과 노인성 황반변성증 환자에 대한 임상시험을 진행하여 중간결과 발표를 통해 안전성과 시력기능의 회복을 확인하였다. 줄기세포 이식후 2주부터 시력의 회복이 관찰되었으며 세포이식후 4개월에는 글자를 구분할 정도의 놀라운 시력회복능을 확인한 상태이다. 국내의 경우 올 3~4월에 첫 번째 임상시험을 진행할 예정에 있다. 본 세포치료제는 세계 최초의 배아줄기세포 유래 세포치료제로 개발될 가능성이 매우 높으며 스타가르트병의 경우 희귀질환으로 임상 1/2상 종료후 상용화가 가능하다.
표1. 인간배아줄기세포 유래 세포치료제 개발현황
개발기관 | 세포명 | 대상질환 | 임상단계 |
Geron | hES-Oligodendrocytes | Acute spinal cord injury | 임상1상 |
ACT/차바이오앤디오스텍 | hES-RPE | Stargardt Macular Dystrophy (SMD) | 임상1상 |
ACT/차바이오앤디오스텍 | hES-RPE | Age-related Macular Dystrophy (AMD) | 임상1/2상 |
ACT/차바이오앤디오스텍 | hES-Hemangioblast (RBC, Platelet) | Transfusion | 전임상 |
차바이오앤디오스텍 | hES-Perivascular Progenitor Cells | Diabetic Retinopathy | 전임상 |
차바이오앤디오스텍 | hES-Cardiomyocytes | Acute Myocardiac Infarction | 전임상 |
Pfizer | hES-RPE | Age-related Macular Dystrophy (AMD) | 전임상 |
Cell Cure Neuroscience | hES-RPE | Age-related Macular Dystrophy (AMD) | 전임상 |
Novocell | hES-Endodermal Progenitor Cells | Type I Diabetes | 전임상 |
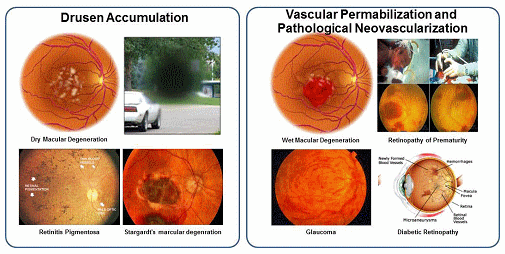
그림 1. 망막손상에 의한 실명질환의 예

그림 2. 인간배아줄기세포 유래 망막색소상피세포
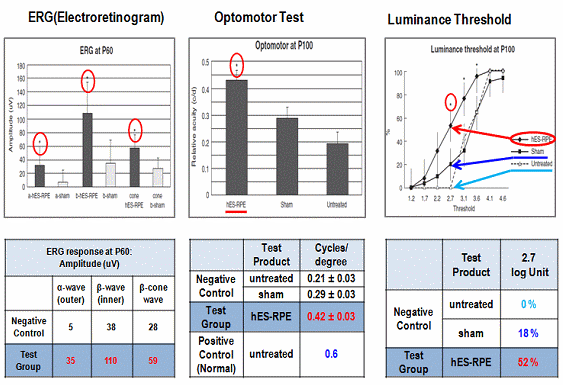
그림 3. 인간배아줄기세포 유래 망막색소상피세포 전임상 효력시험 결과

그림 4. 질환모델동물에 이식된 인간배아줄기세포 유래 망막색소상피세포의 생착
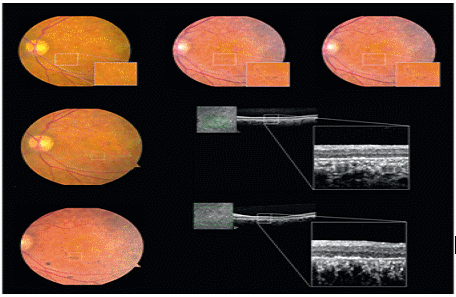
그림 5. 인간배아줄기세포 유래 망막색소상피세포를 이식한 스타가르트 환자 안구내의 세포생착 확인 결과
표 2. 인간배아줄기세포 유래 망막색소상피세포 이식 스타가르트 환자의 시력회복

그 외에도 배아줄기세포 유래 세포치료제는 표에서 보는바와 같이 몇몇 기업에서 개발중이나 아직 임상단계에 진입된 품목은 없는 상황이다. 차바이오앤디오스텍은 현재 배아줄기세포 유래의 혈액-혈관형성세포 (hemangioblast)를 이용하여 수혈이 가능한 적혈구와 혈소판 생산, 당뇨병성 망막변성증과 급성 심근경색증을 치료할 수 있는 세포치료제 등을 개발완료하여 전임상 독성시험단계를 진행하고 있는 상황이다.
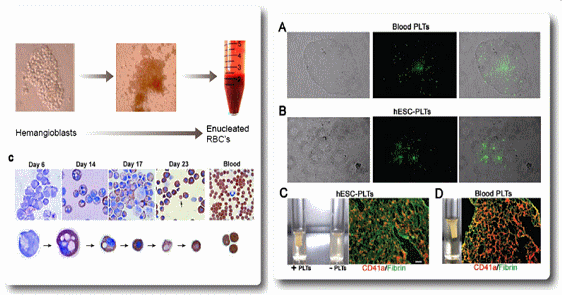
그림 6. 인간배아줄기세포 유래 인공적혈구(좌측)와 혈소판 (우측) 생산기술 개발
(2) 성체줄기세포 치료제
성체줄기세포는 조직특이적 줄기세포로서 골수, 제대혈, 지방, 태반, 탯줄, 말초혈, 양수, 피부 등 다양한 조직으로부터 분리가능하다. 현재 성체줄기세포 치료제의 혈액암등과 같은 혈액질환을 제외하고는 거의 대부분은 간엽줄기세포 (MSC)를 분리 및 증식하여 이용하고 있는 상황이다. 간엽줄기세포는 타 성체줄기세포에 비해 증식능이 우수하며 다양한 세포로의 분화능과 함께 면역관용 또는 면역억제 작용을 갖고 있어 광범위한 세포치료제로 활용되고 있다. 국내에서 개발된 세포치료제 모두 골수, 지방 및 제대혈 유래의 간엽줄기세포 치료제이다.
성체줄기세포 치료제는 퇴행성 관절염이나 일부 뇌질환을 제외하고는 모두 혈관을 통한 이식방법을 채택하고 있다. 이러한 근거는 많은 연구를 통해 생체내 주입된 줄기세포는 손상된 조직이나 기관으로 이동하는 것 보다는 이식된 줄기세포로부터 분비되는 다양한 물질에 의해 생체내 전구세포 혹은 세포의 활성화를 유도한다는 작용기작에 근거를 두고 있다. 실제 간엽줄기세포는 다양한 cytokines, chemokines와 growth factors를 분비하며 이들은 세포성장 촉진, 항염증작용, 면역관용 및 억제작용 그리고 혈관형성 촉진 등의 작용을 담당하는 것으로 알려져 있다. 성체줄기세포를 활용하는 세포치료제 임상적용은 매우 다양한 줄기세포와 다양한 질환을 대상으로 이용되고 있다.
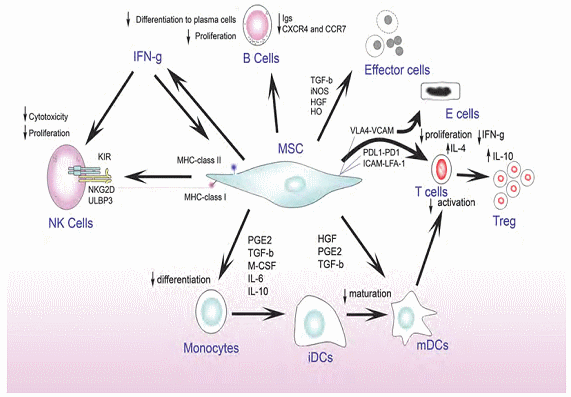
그림 7. 간엽줄기세포의 다양한 분비성분 및 역할
우리나라를 포함하여 일부의 국가에서는 성체조직에서 단순분리 등과 같은 최소한의 조작이 이루어진 줄기세포 이식은 임상술기로 분류하여 별도의 인허가 절차 없이 의료진의 권한으로 임상적용이 가능하며, 만약 분리된 줄기세포의 증식을 위한 배양 등이 진행될 경우에는 세포치료제로 분류하여 반드시 세포의 제조공정 및 품질관리 (기준및 시헙법)등의 모든 절차와 문서, 전임상 안전성 및 유효성 시험 및 임상시험계획서 등의 절차를 식약청의 인허가 절차에 따라 임상에 적용하도록 법적으로 규정되어 있다.
표 3. 골수줄기세포를 이용한 세포치료제 개발 현황
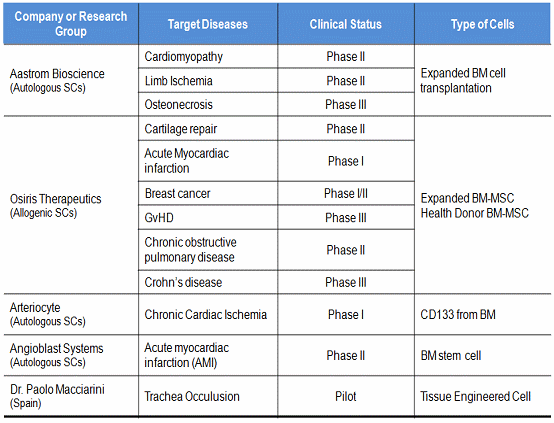
표 4. 태아 뇌줄기세포를 이용한 세포치료제 개발현황
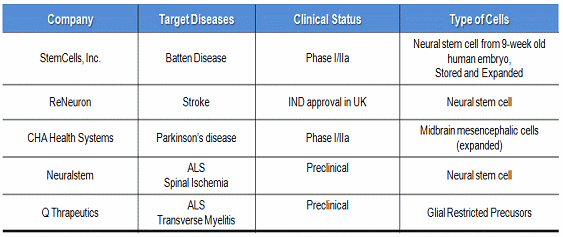
표 5. 제대혈 줄기세포를 이용한 세포치료제 개발현황
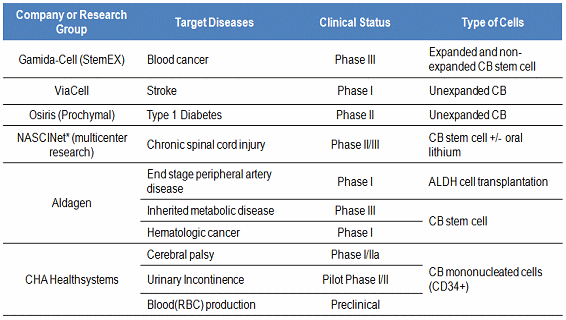
표 6. 태반줄기세포를 이용한 세포치료제 개발현황
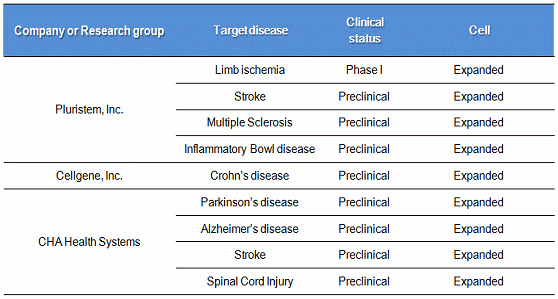
표 7. 지방줄기세포를 이용한 세포치료제 개발현황
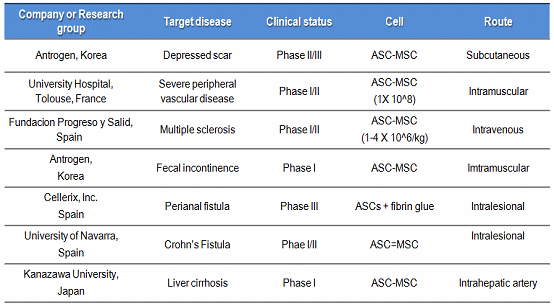
2) 줄기세포 화장품
줄기세포의 생체내 작용기작은 손상된 세포와의 대체를 통한 직접적 효과 (cellular effect)와 함께 이식된 줄기세포로부터 다량으로 분비된 유용물질에 의한 생체내 환경조정을 통한 간접적 효과 (humoral effect)로 구분된다. 줄기세포 화장품의 개발은 줄기세포 배양시 분비되는 다양한 물질중 피부의 노화예방, 주름개선 및 미백효과와 관련된 물질이 함유된 것으로부터 개발되었다. 줄기세포 배양시 분비되는 물질중 화장품에 이용가능한 대표적 물질로는 피부재생효과를 나타내는 성장촉진인자, 피부손상을 억제할 수 있는 항산화물질, 손상피부의 신속한 복구를 담당하는 혈관형성촉진인자와 항염증인자로 구분된다. 줄기세포 배양산물을 이용한 화장품 개발은 불과 몇 년정도의 개발역사를 지니고 있음에도 불구하고 국내외 적으로 대형 화장품사들이 경쟁적으로 제품을 출시하거나 개발중에 있다. 국내의 경우 10여개 정도의 업체가 줄기세포 배양물 화장품을 제조 및 판매하고 있으며 법적으로는 안전성이 확보된 원로로써 줄기세포 배양물을 인정하고 있다. 다만, 인체유래의 세포를 활용한 화장품 원료물질 생산과 관련된 안전성 확보를 위해 최근 식약청에서는 세포치료제 개발과 거의 유사한 수준의 가이드라인과 규제안을 제정하였다. 줄기세포를 포함하는 인체세포나 조직배양액에 대해서는 국가마다 규제가 다양한데 한국, 미국, 일본등 대다수의 국가에서는 자체 규제 및 관리지침 또는 가이드라인을 제정하여 화장품 원료물질로서 인정하고 있으나 유럽의 경우는 인체세포 및 조직유래 물질을 사용금지성분 목록 (EU Annex II)에 포함시켜 사용을 금지하고 있다.
표 8. 국내외 줄기세포 화장품 현황
개발기관 | 화장품명 | 줄기세포 | 비고 |
Voss Laboratories | Amatokin | Expanded Adipose Stem Cell |
|
Dermaheal | StemC’rum | Expanded Adipose Stem Cell |
|
차바이오앤디오스텍 | Evercell | Embryonic Stem Cell |
|
LG 생활건강 | OHUI The Fisrst | Embryonic Stem Cell | 차바이오앤디오스텍 기술이전 |
LG 생활건강 | Isaknox Te’rvina | Placenta Stem Cell | 차바이오앤디오스텍 기술이전 |
Christian Dior | Capture R60/80 | - | 줄기세포 활성화 성분 |
RNL Bio | Dr. Jucre | Expanded Adipose Stem Cell |
|
Amore Pacific | IOPE Stem Polio | Plant Stem Cell | 식물 발아추출물 |
프로스테믹스 | AAPE Stem Cell Cream | Expanded Adipose Stem Cell |
|
파미셀 | BeuCell | Expanded Adipose/Bone Marrow Stem Cell |
|
3. 결론
줄기세포는 재생의학이라는 새로운은 의학분야의 패러다임을 창출하였고 매우 짧은 기간에도 불구하고 생명과학 분야에서 가장 빠른 성장률과 기술이 개발되고 있는 분야이다. 다양한 줄기세포의 발굴과 이를 활용하는 기술 및 생체내외의 작용기전의 해석등과 같은 연구개발이 급속히 진행되고 있다. 국내의 경우 기초원천기술과 함께 줄기세포의 산업화 적용을 위한 다양한 치료제 개발의 국제적 강점을 지니고 있어 신규 성장동력 산업으로의 가능성이 매우 높을 것으로 판단된다. 줄기세포 배양산물을 이용한 화장품 개발 분야 역시 세계에서 가장 많은 화장품을 이용하는 국가로서 화장품 원료물질로서의 소재개발과 제품개발은 의약품 시장에 버금가는 화장품 산업의 발전과 부가가치 창출에 크게 기여할 것으로 예상된다. 줄기세포를 활용하는 기술은 비단 바이오의약품과 화장품 개발외에도 기초연구분야와 산약개발등의 유관학문과 산업의 발전에도 적극적으로 응용될 수 있는 분야로도 인식되고 있다. 향후 세포치료제 개발과 관련된 제도적 가이드라인의 정비, 전문인력의 양성 및 국가 인프라 구축등의 시스템의 종합적 정비가 진행되고 국제수준에 부합된 합리적 임상시험 등이 진행될 수 있도록 범국가적 지원과 관련 산업계의 노력이 한층 필요할 때다.
참고문헌
1. Steven D Schwartz, Jean-Pierre Hubschman, Gad Heilwell, Valentina Franco-Cardenas,
Carolyn K Pan, Rosaleen M Ostrick, Edmund Mickunas, Roger Gay, Irina Klimanskaya,
Robert Lanza Embryonic stem cell trials for macular degeneration: a preliminary report.
Lancet 6736(12):60028-2.
2. Lund RD, Wang S, Klimanskaya I, et al. Human embryonic stem cell-derived cells rescue
visual function in dystrophic rats. Cloning Stem Cells 2006; 8: 189–99.
3. Lu B, Malcuit C, Wang S, et al. Long-term safety and function of RPE from human
embryonic stem cells in preclinical models of macular degeneration. Stem Cells 2009; 27:
2126–35.
4. Cho, S.W. et al. Improvement of postnatal neovascularization by human embryonic stem
cell derived endothelial-like cell transplantation in a mouse model of hindlimb ischemia.
Circulation 2007; 116: 2409-2419.
5. Draper JS, Andrews PW. Embryonic stem cells: advances toward potential therapeutic use.
Curr Opin Obstet Gynecol. 2002 14(3):309-315.
6. Gabriel I. Nistror, Minodora O. Totoiu, Nadia Haque, Mellisa K. Carpenter, Hans S.
Keoirstead. Human Embryonic Stem Cells Differentiate into Oligodendrocytes in High Purity
and Myelinate After Spinal Cord Transplantation. Glia 2007; 49:385-396
7. Klimanskaya I, Hipp J, Rezai KA, West M, Atala A, Lanza R. Derivation and comparative
assessment of retinal pigment epithelium from human embryonic stem cells using
transcriptomics. Cloning Stem Cells 2004; 6(3):217-245.
8. Lee JE, Kang MS, Park MH, Shim SH, Yoon TK, Chung HM, Lee DR. Evaluation of 28 Human
Embryonic Stem Cell Lines for Use as Unrelated Donors in Stem Cell Therapy: Implications
of HLA and ABO Genotypes.Cell Transplantation 2010; 19(11):1383-1395.
9. Lu SJ et al. Generation of functional hemangioblasts from human embryonic stem cells.
Nature methods 2007; 4: 501-509.
10. Lu SJ, Li F, Yin H, Feng Q, Kimbrel EA, Hahm E, Thon JN, Wang W, Italiano JE, Cho J,
Lanza R. Platelets generated from human embryonic stem cells are functional in vitro and
in the microcirculation of living mice. Cell Res 2011; in press.
11. Lund RD, Wang S, Klimanskaya I, Holmes T, Ramos-Kelsey R, Lu B, Girman S, Bischoff N,
Sauv Y, Lanza R. Human embryonic stem cell-derived cells rescue visual function in
dystrophic RCS rats. Cloning Stem Cells 2006; 8(3):189-199.
12. NIH Website. www.clinicaltrial.gov.
13. 서동삼. 국내외 줄기세포 치료제/화장품 제품 개발동향. 2012 줄기세포산업 실태와 기술/시장분 석 및 육성전략 세미나. 산업교육연구소
14. Cell Therapy Markets- Trends, Industry, Participants, Product Overviews and Market
Drivers. 2007. TriMark Publication.
15. Adult Stem Cells Market Trends 2011. Select Biosciences. 2011.