오늘 3월 27일자로 현오석 부총리 겸 기획재정부 장관은 정부서울청사에서 경제관계장관회의를 열고 이런 내용을 골자로 하는 규제 완화 후속조치 계획을 밝혔습니다.
더불어 ”내부지침이나 행정조치로 즉시 해결 가능한 과제는 4월까지 완료하고 시행령, 시행규칙 등 법령 개정과제는 국무조정실과 협의해 6월 말까지 개선을 완료하겠다”고 밝혔습니다.
언론에 따르면, “일자리 창출 효과가 크고 성장잠재력이 높은 5대 유망 서비스산업 육성을 위해 분야별 TF를 구성하는 중”이라며 이어 보건의료, 교육, 관광 등 다른 서비스산업 TF에서 준비 중인 부문별 발전방안을 추후 경제관계장관회의에서 논의하기로 한 것으로 전해집니다.
이에 발표된 보도자료와<제1차 규제개혁장관회의 및 민관합동 규제개혁 점검회의 현장건의 후속조치 계획>자료를 공유하오니 참고하시기 바랍니다.
==================
제1차 규제개혁장관회의 및 민관합동 규제개혁 점검회의
현장건의 후속조치 계획
2014. 3. 27.
관계부처 합동
순서
Ⅰ. 후속조치 개요 1
Ⅱ. 후속조치 추진 계획 2
1. 수용 과제 2
2. 추가 검토 과제 26
3. 수용곤란 및 대안검토 과제 30
Ⅲ. 세부 추진계획 32
===============================
* 보건의료부분 관련 조치는 아래와 같습니다. 자료 14쪽~20쪽을 참조하세요.
1-2 유망 서비스산업 규제
(1) (보건‧의료) 의료법인 해외진출 지원(건의: 박성민 보바스 병원장)
□ (건의 내용) 의료법인의 해외진출시 비영리법인으로 활동하여 많은 제약이 발생하므로 영리자법인 허용을 통한 애로 해소 필요
ㅇ 그간 의료법인의 자법인 설립은 정책적으로 불허되어왔으며, 진료 외 부대사업도 8개 분야*로 엄격히 제한
* 의료인 양성‧보수 교육, 의료기기 임대‧판매, 산후조리, 장례식장, 구내식당 등
□ (추진 방안) 의료법인의 자법인 설립이 가능하도록 자법인 설립요건과 절차 등을 규정하는 가이드라인을 마련(복지부, ‘14.6월)
ㅇ 의료법인 부대사업을 확대를 위해 의료법 시행규칙 개정(‘14.6월)
* 의약품‧의료기기의 연구 및 개발, 여행업, 외국인환자 유치업 등
ㅇ 투자초기부터 해외진출 완료시까지 자법인 설립, 현지 정보제공 등을 원스톱 서비스로 지원하여 의료기관 해외진출 분야에서 자법인 설립사례를 조속히 창출
□ (보완 방안) 자법인 설립의 부작용 가능성을 차단하기 위해 의료법 취지, 세법상 성실공익법인 요건 등을 참작하여 자법인 남용방지 장치를 가이드라인에 반영
(2) (보건‧의료) 종합의료시설 용지제도 개선(건의: 박성민 보바스병원장)
□ (건의 내용) 도시계획시설로 결정된 ‘종합의료시설 용지’에 종합병원 외의 의료기관 건립도 허용
ㅇ 현재 도시계획시설로 결정된 종합의료시설에는 종합병원*만 설치 가능
* 100병상 이상의 병원으로 내과, 외과, 소아청소년과, 산부인과 등 7개 이상의 진료과목을 보유한 병원
□ (추진 방안) 택지개발지구 내 의료기관의 다양한 구성이 가능하도록 입지규제를 완화
ㅇ 현행 지침상 ‘종합의료시설 용지’를 ‘의료시설 용지’로 변경
(국토부, 「택지개발업무처리지침」 개정, ’14.6월)
ㅇ 전문병원, 일반병원 등도 의료시설 용지에 입주할 수 있도록 허용(국토부, 「도시․군계획시설 기준규칙」 개정, ‘14.12월)
(3) (보건․의료) 원격의료 허용(건의: 인성정보 김홍진 이사)
□ (건의 내용) 안전성․유효성 검증 등을 위해 원격의료 도입은 단계적으로 추진할 필요
ㅇ 의사․의사간, 해외환자, 재외국민 원격의료 등 적용이 쉬운 부문부터 우선 추진한 후, 의사․환자간으로 확대
□ (추진 방안) 6개월간(14.4월~10월) 의사‧환자간 원격의료 시범사업을 실시하고, 국회입법 과정에서 동 결과를 반영하여 원격의료 범위를 확대(복지부)
* 의사‧환자간 원격의료 허용을 위한 의료법 개정(안) 국회 제출(14.3월)
ㅇ 의사‧의사간 원격의료 시범사업은 일부지역*에서 시행중
* (‘09년) 경북 영양군․강원도 강릉시․충남 보령시
(’13년) 강원도 전 지역 확대
□ (보완 방안) 시범사업 기획 단계부터 의사협회의 의견을 반영, 의사협회와 공동으로 시범사업을 실시
(4) (보건‧의료) 의료기기 제조업 허가를 제조업체별 허가로 전환(건의: 인성정보 김홍진 이사)
□ (건의 내용) 의료기기 제조업 허가를 제조 공장별 허가에서
제조 업체별 허가로 전환할 필요
ㅇ 현행 제도에서는 기존 제조업자가 새로운 지역에 공장을 신설하는 경우 중복하여 제조업 허가를 받아야 하는 불편 존재
□ (추진 방안) 동일한 제조업자가 추가적인 제조업 허가 없이 타지역에서 공장을 신설할 수 있도록 개선(식약처, ‘14.4월 의료기기법 개정안 국회제출)
(5) (보건‧의료) 의료기기 임상시험 이중승인 완화(건의: 인성정보 김홍진 이사)
□ (건의 내용) 의료기기 임상시험은 위해도와 상관없이 정부승인과 임상시험심사위원회*의 이중승인을 요구해 업계 부담 가중
* 임상시험 피시험자를 보호하기 위해 임상시험기관 내에 독립적으로 설치한 상설위원회로 경험․자격을 갖춘 5인 이상 위원으로 구성
ㅇ 피험자에 대한 위험성이 낮은 임상시험은 정부승인 없이 위원회 승인만으로 가능하도록 개선 필요
* 미국의 경우, 임플란트, 생명유지용 의료기기 등 중대위험 의료기기(Significant Risk Device)의 경우에만 정부 승인 요구
□ (추진 방안) 우선 적극적 유권해석을 통해 가능한 범위 내에서 위원회 승인만으로 임상시험 실시를 허용(식약처, ‘14.4월)
ㅇ 위험성이 낮은 임상시험은 위원회 승인만으로 임상시험이 가능토록 법률 개정(의료기기법 개정안 국회제출, ’14.11월)
(6) (보건‧의료) 신의료기기 인허가기간 단축(건의: 인성정보 김홍진 이사)
□ (건의 내용) 美 FDA의 Innovation Pathway*와 같이 새로 개발되는 의료기기는 R&D 단계부터 인허가를 지원하도록 건의
* 혁신적인 신개발 의료기기에 대해 FDA에서 R&D 단계부터 개발업체와 함께 임상․허가 등을 공동 수행하여 인․허가기간을 단축하는 제도
□ (추진 방안) 허가도우미 제도*를 활용하여 인허가기간 단축 지원(식약처)
* 그간 68개 제품을 허가도우미 대상으로 지정하여 R&D 단계부터 1:1 맞춤형으로 지원(현재까지 허가 완료된 11개 제품은 약 1~2년의 인허가 기간이 단축)
ㅇ 허가도우미 제도 이용을 활성화하기 위해 관련 업계를 대상으로 순회설명회 개최, 안내자료 배포 등 홍보 강화(’14.4월)
(7) (보건‧의료) 스마트폰센서 의료기기 인증 애로해소(건의: 이승철 전경련 부회장)
□ (건의 내용) 스마트폰에 건강관리 목적의 센서 등을 추가시 의료기기로 인증*을 받게 되어 신제품 출시에 애로가 존재
* 「의료기기법」 제2조 제1항, 「의료기기 품목 및 품목별 등급에 관한 규정」
ㅇ 단순 건강증진 보조 제품은 국제기준과의 조화, 국민들의 보건안전 진흥 등을 고려하여 의료기기에서 제외해 주기를 요청
□ (추진 방안) 스마트폰 심(맥)박수 측정센서의 경우 의료기기 인증없이 출시가 가능토록 허용(식약처, 의료기기품목에 관한 규정 개정, ‘14.4월)
ㅇ 운동‧레저 목적의 스마트폰, 이어폰, 러닝머신 등과 결합된 심(맥)박수 측정센서는 의료기기법 관리대상에서 제외
* 美, 英 등은 운동목적의 심(맥)박수계는 의료기기로 관리하고 있지 않음
(8) (보건‧의료) 국내보험사 외국인 환자 유치 허용(건의: 이승철 전경련 부회장)
□ (건의 내용) 국내보험사가 외국인환자도 유치할 수 있도록 허용 건의
ㅇ 보험회사의 해외환자 유치업 참여를 허용하여, 보험업의 신규 수익원을 발굴하는 한편 국내 의료관광 활성화 지원 도모
□ (추진 방안) 현재 “국내 또는 외국보험회사와 보험계약을 체결한 외국인 환자”에 대한 보험회사의 유치행위는 허용하는 의료법 개정안 추진 중(복지부, ‘13.5월 국회제출)
ㅇ 향후 의료법의 조속한 국회통과를 위해, 관련부처와 긴밀한 협업체계 구축 및 지원노력 강화
□ (보완 방안) 해외 보험계약자를 대상으로 보험사의 외국인환자 유치업을 제한적으로 허용*하되 유치업자 등록 취소 요건을 대폭 강화**
* 외국인 환자 유치만 허용하고 관련 숙박알선과 항공권구매 대행 불허
** 과도한 수수료 요구 등 중대 시장교란 행위는 등록취소(2년간 재등록 금지)
ㅇ 의료계 등 추가 의견 수렴 지속
(9) (보건‧의료) 의료기기 허가·심사 공공기관 위탁(건의: 인성정보 김홍진 이사)
□ (건의 내용) 위해도가 낮은 1․2등급 의료기기 허가․심사를
공공기관에 위탁하여 심사기간을 단축할 필요
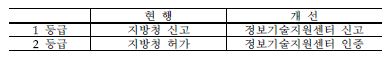
※ (현행) 위해도가 높은 3․4등급은 식약처에서 허가, 2등급은 6개 민간위탁기관에서 기술문서심사 후 6개 지방청에서 허가, 1등급은 6개 지방청 신고
□ (추진 방안) 의료기기법 개정을 통해 의료기기 허가 기간 단축(식약처)
ㅇ 2등급 의료기기를 허가에서 인증으로 전환하고, 1등급 신고와 2등급 인증은 ‘의료기기 정보기술지원센터’에 위탁